Законы идеальных газов. Зависимость давления газа от температуры Как зависит объем газа от давления
Аннотация: традиционное изложение темы, дополненное демонстрацией на компьютерной модели.
Из трех агрегатных состояний вещества наиболее простым является газообразное состояние. В газах силы, действующие между молекулами, малы и при определенных условиях ими можно пренебречь.
Газ называется идеальным , если:
Можно пренебречь размерами молекул, т.е. можно считать молекулы материальными точками;
Можно пренебречь силами взаимодействия между молекулами (потенциальная энергия взаимодействия молекул много меньше их кинетической энергии);
Удары молекул друг с другом и со стенками сосуда можно считать абсолютно упругими.
Реальные газы близки по свойствам к идеальному при:
Условиях, близких к нормальным условиям (t = 0 0 C, p = 1.03·10 5 Па);
При высоких температурах.
Законы, которым подчиняется поведение идеальных газов, были открыты опытным путем достаточно давно. Так, закон Бойля - Мариотта установлен еще в 17 веке. Дадим формулировки этих законов.
Закон Бойля - Мариотта. Пусть газ находится в условиях, когда его температура поддерживается постоянной (такие условия называются изотермическими ).Тогда для данной массы газа произведение давления на объем есть величина постоянная:
Эту формулу называют уравнением изотермы . Графически зависимость p от V для различных температур изображена на рисунке.

Свойство тела изменять давление при изменении объема называется сжимаемостью . Если изменение объема происходит при T=const, то сжимаемость характеризуется изотермическим коэффициентом сжимаемости который определяется как относительное изменение объема, вызывающее изменение давления на единицу.

Для идеального газа легко вычислить его значение. Из уравнения изотермы получаем:

Знак минус указывает на то, что при увеличении объема давление уменьшается. Т.о., изотермический коэффициент сжимаемости идеального газа равен обратной величине его давления. С ростом давления он уменьшается, т.к. чем больше давление, тем меньше у газа возможностей для дальнейшего сжатия.
Закон Гей - Люссака. Пусть газ находится в условиях, когда постоянным поддерживается его давление (такие условия называются изобарическими ). Их можно осуществить, если поместить газ в цилиндр, закрытый подвижным поршнем. Тогда изменение температуры газа приведет к перемещению поршня и изменению объема. Давление же газа останется постоянным. При этом для данной массы газа его объем будет пропорционален температуре:
![]()
где V 0 - объем при температуре t = 0 0 C, - коэффициент объемного расширения газов. Его можно представить в виде, аналогичном коэффициенту сжимаемости:

Графически зависимость V от T для различных давлений изображена на рисунке.

Перейдя от температуры в шкале Цельсия к абсолютной температуре , закон Гей - Люссака можно записать в виде:
Закон Шарля. Если газ находится в условиях, когда постоянным остается его объем (изохорические условия), то для данной массы газа давление будет пропорционально температуре:
![]()
где р 0 - давление при температуре t = 0 0 C, - коэффициент давления . Он показывает относительное увеличение давления газа при нагревании его на 1 0:

Закон Шарля также можно записать в виде:
Закон Авогадро: один моль любого идеального газа при одинаковых температуре и давлении занимает одинаковый объем. При нормальных условиях (t = 0 0 C, p = 1.03·10 5 Па) этот объем равен м -3 /моль.
Число частиц, содержащихся в 1 моле различных веществ, наз. постоянная Авогадро :
Легко вычислить и число n 0 частиц в 1 м 3 при нормальных условиях:

Это число называется числом Лошмидта .
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т.е.
где - парциальные давления - давления, которые бы оказывали компоненты смеси, если бы каждый из них занимал объем, равный объему смеси при той же температуре.
Уравнение Клапейрона - Менделеева. Из законов идеального газа можно получить уравнение состояния , связывающее Т, р и V идеального газа в состоянии равновесия. Это уравнение впервые было получено французским физиком и инженером Б. Клапейроном и российским учеными Д.И. Менделеевым, поэтому носит их имя.
Пусть некоторая масса газа занимает объем V 1 , имеет давление p 1 и находится при температуре Т 1 . Эта же масса газа в другом состоянии характеризуется параметрами V 2 , p 2 , Т 2 (см. рисунок). Переход из состояния 1 в состояние 2 осуществляется в виде двух процессов: изотермического (1 - 1") и изохорического (1" - 2).

Для данных процессов можно записать законы Бойля - Мариотта и Гей - Люссака:
Исключив из уравнений p 1 " , получим
Так как состояния 1 и 2 были выбраны произвольно, то последнее уравнение можно записать в виде:
![]()
Это уравнение называется уравнением Клапейрона , в котором В - постоянная, различная для различных масс газов.
Менделеев объединил уравнение Клапейрона с законом Авогадро. Согласно закону Авогадро, 1 моль любого идеального газа при одинаковых p и T занимает один и тот же объем V m , поэтому постоянная В будет одинаковой для всех газов. Эта общая для всех газов постоянная обозначается R и называется универсальной газовой постоянной . Тогда
Это уравнение и является уравнением состояния идеального газа , которое также носит название уравнение Клапейрона - Менделеева .
Числовое значение универсальной газовой постоянной можно определить, подставив в уравнение Клапейрона - Менделеева значения p, T и V m при нормальных условиях:
Уравнение Клапейрона - Менделеева можно записать для любой массы газа. Для этого вспомним, что объем газа массы m связан с объемом одного моля формулой V=(m/M)V m , где М - молярная масса газа . Тогда уравнение Клапейрона - Менделеева для газа массой m будет иметь вид:
![]()
где - число молей.
Часто уравнение состояния идеального газа записывают через постоянную Больцмана:
![]()
Исходя из этого, уравнение состояния можно представить как
![]()
где - концентрация молекул. Из последнего уравнения видно, что давление идеального газа прямо пропорционально его температуре и концентрации молекул.
Небольшая демонстрация законов идеального газа. После нажатие кнопки "Начнем" Вы увидите комментарии ведущего к происходящему на экране (черный цвет) и описание действий компьютера после нажатия Вами кнопки "Далее" (коричневый цвет). Когда компьютер "занят" (т.е. идет опыт) эта кнопка не активна. Переходите к следующему кадру, лишь осмыслив результат, полученный в текущем опыте. (Если Ваше восприятие не совпадает с комментариями ведущего, напишите!)
Вы можете убедиться в справедливости законов идеального газа на имеющейся
Связь между давлением, температурой, объемом и количеством молей газа ("массой" газа). Универсальная (молярная) газовая постоянная R. Уравнение Клайперона-Менделеева = уравнение состояния идеального газа.
|
Ограничения практической применимости:
Внутри диапазона точность уравнения превосходит точность обычных современных инженерных средств измерения. Для инженера важно понимать, что для всех газов возможна существенная диссоциация или разложение при повышении температуры. |
|
|
|
Давайте решим парочку задач относительно газовых объемных и массовых расходов в предположении, что состав газа не изменяется (газ не диссоциирует) - что верно для большинства газов в указанных выше .
Данная задача актуальна в основном, но не только, для применений и устройств, в которых напрямую измеряется объем газа.
V 1 и V 2 , при температурах, соответственно, T 1 и T 2 и, пусть T 1 < T 2 . Тогда мы знаем, что:
Естественно, V 1 < V 2
- показатели объемного счетчика газа тем "весомее", чем ниже температура
- выгодно поставлять "теплый" газ
- выгодно покупать "холодный" газ
Как с этим бороться? Необходима хотя бы простая температурная компенсация, т.е в считающее устройство должна подаваться информация с дополнительного датчика температуры.
Данная задача актуальна в основном, но не только, для применений и устройств, в которых напрямую измеряется скорость газа.
Пусть счетчик () в точке доставки дает объемные накопленные расходы V 1 и V 2 , при давлениях, соответственно, P 1 и P 2 и, пусть P 1 < P 2 . Тогда мы знаем, что:
Естественно, V 1 >V 2 для одинаковых количеств газа при данных условиях. Попробуем сформулировать несколько важных на практике выводов для данного случая:
- показатели объемного счетчика газа тем "весомее", чем выше давление
- выгодно поставлять газ низкого давления
- выгодно покупать газ высокого давления
Как с этим бороться? Необходима хотя бы простая компенсация по давлению, т.е в считающее устройство должна подаваться информация с дополнительного датчика давления.
В заключение, хотелось бы отметить, что, теоретически, каждый газовый счетчик должен иметь и температурную компенсацию и компенсацию по давлению. Практически же......
Введение
Состояние идеального газа полностью описывается измеряемыми величинами: давлением, температурой, объемом. Отношение между этими тремя величинами определяется основным газовым законом:
Цель работы
Проверка закона Бойля-Мариотта.
Решаемые задачи
Измерение давления воздуха в шприце при изменении объема учитывая, что температура газа постояна.
Экспериментальная установка
Приборы и принадлежности
Манометр
Ручной вакуумный насос
В данном эксперименте закон Бойля – Мариотта подтверждается с помощью установки показанной на рисунке 1. Объем воздуха в шприце определяется следующим образом:
где p 0 атмосферное давление, аp– давление, измеренное при помощи манометра.
Порядок выполнения работы
Установите поршень шприца на отметке 50 мл.
Плотно надеть свободный конец соединительного шланга ручного вакуумного насоса на выходной патрубок шприца.
Выдвигая поршень, увеличивайте объем с шагом 5 мл, фиксируйте показания маномета по черной шкале.
Чтобы определить давление под поршнем, надо из атмосферного давления вычесть показания монометра, выраженного в паскалях. Атмосферное давление равно приблизительно 1 бар, что соответствует 100 000 Па.
Для обработки результатов измерений следует учитывать наличие воздуха в соединительном шланге. Для этого измерьте расчитайте объем соединительного шланга, измерив длину шланга рулеткой, а диаметр шланга штангенциркулем, учитывая, что толщина стенок составляет 1,5 мм.
Постройте график измеренной зависимости объема воздуха от давления.
Рассчитайте зависимость объема от давления при постоянной температуре по закону Бойля-Мариотта и постройте график.
Сравните теоретические и экспериментальные зависимости.
2133. Зависимость давления газа от температуры при постоянном объеме (закон шарля)
Введение
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в 1787 г. Жаком Александром Сезаром Шарлем (1746-1823). Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру Т , а соответствующее давлениер - по манометру. Наполнив сосуд тающим льдом, определяли давлениер о , и соответствующую температуруТ о . Было установлено, что если при 0 С давлениер о , то при нагревании на 1 С приращение давления будет в р о . Величинаимеет одно и то же значение (точнее, почти одно и тоже) для всех газов, а именно 1/273 C -1 . Величинуназывают температурным коэффициентом давления.

Закон Шарля позволяет рассчитать давление газа при любой температуре, если известно его давление при температуре 0 C. Пусть давление данной массы газа при 0 Cв данном объемеp o , а давление того же газа при температуреt p . Температура меняется наt , а давления изменяется на р о t , тогда давлениер равно:
При очень низких температурах, когда газ приближается к состоянию сжижения, а также в случае сильно сжатых газов закон Шарля неприменим. Совпадение коэффициентов и, входящих в закон Шарля и закон Гей-Люссака, не случайно. Так как газы подчиняются закону Бойля - Мариотта при постоянной температуре, тоидолжны быть равны между собой.
Подставим значение температурного коэффициента давления в формулу температурной зависимости давления:
|
|
Величину (273+ t ) можно рассматривать как значение температуры, отсчитанное по новой температурной шкале, единица которой такая же, как и у шкалы Цельсия, а за нуль принята точка, лежащая на 273 ниже точки, принятой за нуль шкалы Цельсия, т. е. точки таяния льда. Нуль этой новой шкалы называют абсолютным нулем. Эту новую шкалу называют термодинамической шкалой температур, гдеT t +273 .
Тогда, при постоянном объеме справедлив закон Шарля:
|
|
Цель работы
Проверка закона Шарля
Решаемые задачи
Определение зависимости давления газа от температуры при постоянном объеме
Определение абсолютной шкалы температур путем экстраполяции в сторону низких температур
Техника безопасности
Внимание: в работе используется стекло.
Будьте предельно аккуратны при работе с газовым термометром; стеклянным сосудом и мерным стаканом.
Будьте предельно внимательны при работе с горячей водой.
Экспериментальная установка
Приборы и принадлежности
Газовый термометр
Мобильный CASSY Lab
Термопара
Электрическая нагревательная плитка
Стеклянный мерный стакан
Стеклянный сосуд
Ручной вакуумный насос
При откачке воздуха при комнатной температуре с помощью ручного насоса, создается давление на столб воздуха р0+р, где р 0 – внешние давление. Капля ртути также оказывает давление на столб воздуха:
В данном эксперименте этот закон подтверждается с помощью газового термометра. Термометр помещают в воду с температурой около 90°С и эта система постепенно охлаждается. Откачивая воздух из газового термометра с помощью ручного вакуумного насоса, поддерживают постоянный объём воздуха во время охлаждения.
|
|
Порядок выполнения работы
Откройте заглушку газового термометра, подключите к термометру ручной вакуумный насос.
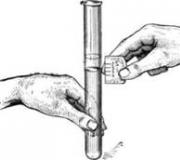
Поверните осторожно термометр как показано слева на рис. 2 и откачайте воздух из него с помощью насоса так, чтобы капелька ртути оказалась в точке a) (см. рис.2).
После того как капелька ртути собралась в точке a)поверните термометр отверстием наверх и спустите нагнетенный воздух ручкойb) на насосе (см. рис.2) осторожно, чтобы ртуть не разделилась на несколько капелек.
Нагреть воду в стеклянном сосуде на плитке до 90°С.
Налить горячую воду в стеклянный сосуд.
Поместить в сосуд газовый термометр, закрепив его на штативе.
Поместить термопару в воду, постепенно эта система охлаждается. Откачивая воздух из газового термометра с помощью ручного вакуумного наноса, поддерживаете постоянный объём столба воздуха в течении всего процесса охлаждения.
Фиксируйте показание манометра р и температуруТ .
Постройте зависимость полного давления газаp 0 +p +p Hg от температуры в о С.
Продолжите график до пересечения с осью абсцисс. Определите температуру пересечения, объясните полученные результаты.
По тангенсу угла наклона определите температурный коэффициент давления.
Рассчитайте зависимость давления от температуры при постоянном объеме по закону Шарля и постройте график. Сравните теоретические и экспериментальные зависимости.
Исследования зависимости давления газа от температуры при условии неизменного объема определенной массы газа впервые были произведены в 1787 г. Жаком Александром Сезаром Шарлем (1746 – 1823). Можно воспроизвести эти опыты в упрощенном виде, нагревая газ в большой колбе, соединенной с ртутным манометром М в виде узкой изогнутой трубки (рис. 6).
Пренебрежем ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, будем отмечать температуру газа по термометру Т , а соответствующее давление – по манометру М . Наполнив сосуд тающим льдом, измерим давление p 0 , соответствующее температуре 0 °C.
Опыты подобного рода показали следующее.
1. Приращение давления некоторой массы составляет определенную часть α того давления, которая имела данная масса газа при температуре 0 °C. Если давление при 0 °C обозначить через p 0 , то приращение давления газа при нагревании на 1 °C есть p 0 +αp 0 .
При нагревании на τ приращение давления будет в τ раз больше, т.е. приращение давления пропорционально приращению температуры .
2. Величина α, показывающая, на какую часть давления при 0 °C увеличивается давление газа при нагревании на 1 °C, имеет одно и то же значение (точнее, почти одно и тоже) для всех газов, а именно 1/273 °C -1 . Величину α называют температурным коэффициентом давления. Таким образом, температурный коэффициент давления для всех газов имеет одно и то же значение, равное 1/273 °C -1 .
Давление некоторой массы газа при нагревании на 1 °C при неизменном объеме увеличивается на 1/273 часть давления, которое эта масса газа имела при 0 °C (закон Шарля ).
Следует, однако, иметь в виду, что температурным коэффициентом давления газа, полученный при измерении температуры по ртутному манометру, не в точности одинаков для разных температур: закон Шарля выполняется только приближенно, хотя и с очень большой степенью точности.
Формула, выражающая закон Шарля.
Закон Шарля позволяет рассчитывать давление газа при любой температуре, если известно его давление при температуре
0 °C. Пусть давление данной массы газа при 0 °C в данном объеме есть p
0 , а давление того же газа при температуре t
есть p
. Приращение температуры есть t
, следовательно, приращение давления равно αp
0 t
и искомое давление
Этой формулой можно пользоваться также и в том случае, если газ охлажден ниже 0 °C; при этом t будет иметь отрицательные значения. При очень низких температурах, когда газ приближается к состоянию сжижения, а также в случае сильно сжатых газов закон Шарля неприменим и формула (2) перестает быть годной.
Закон Шарля с точки зрения молекулярной теории. Что происходит в микромире молекул, когда температура газа меняется, например, когда температура газа повышается и давление его увеличивается? С точки зрения молекулярной теории возможны две причины увеличения давления данного газа: во-первых, могло увеличиться число ударов молекул за единицу времени на единицу площади, во-вторых, мог увеличиться импульс, передаваемый при ударе в стенку одной молекулой. И та, и другая причина требуют увеличения скорости молекул (напоминаем, что объем данной массы газа остается неизменным). Отсюда становится ясным, что повышение температуры газа (в макромире) есть увеличение средней скорости беспорядочного движения молекул (в микромире).
Некоторые типы электрических ламп накаливания наполняют смесью азота и аргона. При работе лампы газ в ней нагревается примерно до 100 °C. Какое должно быть давление смеси газов при 20 °C, если желательно, чтобы при работе лампы давление газа в ней не превышало атмосферного? (ответ: 0,78 кгс/см 2)
На манометрах ставится красная черта, указывающая предел, свыше которого увеличение газа опасно. При температуре 0 °C манометр показывает, что избыток давления газа над давлением наружного воздуха равен 120 кгс/см 2 . Будет ли достигнута красная черта при повышении температуры до 50 °C, если красная черта стоит на 135 кгс/см 2 ? Давление наружного воздуха принять равным 1 кгс/см 2 (ответ: стрелка манометра перейдет за красную черту)
Связь между давлением, температурой, объемом и количеством молей газа ("массой" газа). Универсальная (молярная) газовая постоянная R. Уравнение Клайперона-Менделеева = уравнение состояния идеального газа.
|
Ограничения практической применимости:
Внутри диапазона точность уравнения превосходит точность обычных современных инженерных средств измерения. Для инженера важно понимать, что для всех газов возможна существенная диссоциация или разложение при повышении температуры. |
|
|
|
Давайте решим парочку задач относительно газовых объемных и массовых расходов в предположении, что состав газа не изменяется (газ не диссоциирует) - что верно для большинства газов в указанных выше .
Данная задача актуальна в основном, но не только, для применений и устройств, в которых напрямую измеряется объем газа.
V 1 и V 2 , при температурах, соответственно, T 1 и T 2 и, пусть T 1 < T 2 . Тогда мы знаем, что:
Естественно, V 1 < V 2
- показатели объемного счетчика газа тем "весомее", чем ниже температура
- выгодно поставлять "теплый" газ
- выгодно покупать "холодный" газ
Как с этим бороться? Необходима хотя бы простая температурная компенсация, т.е в считающее устройство должна подаваться информация с дополнительного датчика температуры.
Данная задача актуальна в основном, но не только, для применений и устройств, в которых напрямую измеряется скорость газа.
Пусть счетчик () в точке доставки дает объемные накопленные расходы V 1 и V 2 , при давлениях, соответственно, P 1 и P 2 и, пусть P 1 < P 2 . Тогда мы знаем, что:
Естественно, V 1 >V 2 для одинаковых количеств газа при данных условиях. Попробуем сформулировать несколько важных на практике выводов для данного случая:
- показатели объемного счетчика газа тем "весомее", чем выше давление
- выгодно поставлять газ низкого давления
- выгодно покупать газ высокого давления
Как с этим бороться? Необходима хотя бы простая компенсация по давлению, т.е в считающее устройство должна подаваться информация с дополнительного датчика давления.
В заключение, хотелось бы отметить, что, теоретически, каждый газовый счетчик должен иметь и температурную компенсацию и компенсацию по давлению. Практически же......